Descubre la fascinante Teoría de las Colisiones y su impacto en la química moderna
La química es una ciencia que estudia la composición, estructura, propiedades y transformaciones de la materia. A lo largo de la historia, los científicos han desarrollado diversas teorías para comprender los procesos químicos y describir los cambios que ocurren a nivel molecular. Una de estas teorías es la Teoría de las Colisiones, que juega un papel fundamental en el estudio de las reacciones químicas.
Exploraremos en detalle la Teoría de las Colisiones y su impacto en la química moderna. Veremos cómo esta teoría explica la velocidad de las reacciones, qué factores influyen en la velocidad de una reacción y cómo se pueden aplicar estos conceptos en la práctica. También analizaremos algunos ejemplos concretos de reacciones químicas y cómo la Teoría de las Colisiones nos permite comprender y predecir su comportamiento.
- Qué es la Teoría de las Colisiones y cómo impacta en la química moderna
- Cuáles son los fundamentos de la Teoría de las Colisiones
- Qué papel juegan las colisiones en las reacciones químicas
- Cómo afectan la velocidad y la energía de las colisiones a las reacciones químicas
- Cuál es el concepto de energía de activación en la Teoría de las Colisiones? ¿Por qué es importante
- Cómo influyen la concentración y la temperatura en las colisiones químicas
- Qué tipo de colisiones son más eficientes para producir una reacción química
- Cuáles son algunos ejemplos prácticos de la Teoría de las Colisiones en la vida cotidiana
- Qué aplicaciones tiene la Teoría de las Colisiones en diferentes campos de la química
- Cuáles son los principales avances en la comprensión de las colisiones químicas gracias a la Teoría de las Colisiones
- Preguntas frecuentes (FAQ)
Qué es la Teoría de las Colisiones y cómo impacta en la química moderna
La Teoría de las Colisiones es un concepto fundamental en el campo de la química que nos ayuda a entender cómo ocurren las reacciones químicas y qué factores influyen en su velocidad. Esta teoría postula que para que una reacción química tenga lugar, las partículas reactantes deben colisionar entre sí de manera efectiva.
En términos más simples, podemos decir que la Teoría de las Colisiones establece que las moléculas deben chocar entre sí con la suficiente energía y en la orientación correcta para que haya una transformación química. Las colisiones podrían ser exitosas o no, dependiendo de varios factores como la energía cinética de las moléculas, la concentración de los reactivos, la temperatura y la presencia de catalizadores.
Cómo impacta la Teoría de las Colisiones en la química moderna
La Teoría de las Colisiones tiene un impacto significativo en la química moderna ya que proporciona una base conceptual sólida para comprender y controlar las reacciones químicas. Gracias a esta teoría, los científicos pueden estudiar y predecir cómo se comportarán las sustancias químicas en diferentes condiciones y diseñar procesos más eficientes y seguros.
Uno de los aspectos clave del impacto de la Teoría de las Colisiones en la química moderna es su relación con la velocidad de reacción. Según esta teoría, la velocidad de una reacción química está directamente relacionada con la frecuencia de colisiones efectivas entre las moléculas reactivas. Esto significa que si aumentamos la concentración de los reactivos, la velocidad de reacción también aumentará, ya que habrá más moléculas presentes y, por lo tanto, mayores posibilidades de colisiones exitosas.
Otro factor importante en la velocidad de reacción según la Teoría de las Colisiones es la temperatura. A medida que aumentamos la temperatura, incrementamos la energía cinética promedio de las moléculas, lo que a su vez aumenta la probabilidad de que ocurran colisiones efectivas. Esto explica por qué la mayoría de las reacciones químicas ocurren más rápidamente a temperaturas más altas.
La importancia de la Teoría de las Colisiones en industrias clave
La Teoría de las Colisiones no solo es relevante en el ámbito académico, sino que también tiene un impacto significativo en varias industrias importantes. Una de estas industrias es la farmacéutica, donde la comprensión de las reacciones químicas es esencial para el desarrollo de medicamentos y productos químicos. La aplicación de esta teoría en la investigación farmacéutica permite a los científicos optimizar los procesos de síntesis de nuevos medicamentos y mejorar la efectividad y seguridad de los mismos.
Otra industria en la que la Teoría de las Colisiones juega un papel fundamental es la alimentaria. Los procesos de cocción, fermentación y conservación de los alimentos dependen en gran medida de reacciones químicas controladas. La aplicación de esta teoría en la industria alimentaria permite a los fabricantes ajustar las condiciones de producción para lograr productos finales de calidad y seguros para el consumo.
La Teoría de las Colisiones es una herramienta fundamental en la química moderna que nos ayuda a comprender cómo ocurren las reacciones químicas y qué factores influyen en su velocidad. Su impacto se extiende desde el ámbito académico hasta industrias clave como la farmacéutica y alimentaria. Gracias a esta teoría, los científicos pueden desarrollar nuevos medicamentos, optimizar procesos de producción y mejorar la eficiencia y seguridad en numerosos campos de la química.
Cuáles son los fundamentos de la Teoría de las Colisiones
La Teoría de las Colisiones es una teoría fundamental en química que explica cómo ocurren las reacciones químicas a nivel molecular. Fue propuesta por Max Trautz y William Lewis en la década de 1910 y ha sido ampliamente aceptada desde entonces como uno de los pilares de la química moderna.
Según esta teoría, para que una reacción química ocurra, las moléculas deben colisionar entre sí con la energía suficiente y en la orientación correcta. En otras palabras, las colisiones entre moléculas son cruciales para producir un cambio en los átomos o grupos funcionales presentes en las sustancias en reacción.
La Teoría de las Colisiones se basa en varios conceptos fundamentales:
- Energía de activación: es la energía mínima requerida para que una colisión entre moléculas sea efectiva y conduzca a una reacción química. Las moléculas deben tener suficiente energía cinética para superar la barrera de energía de activación y así poder reorganizarse y formar nuevos compuestos.
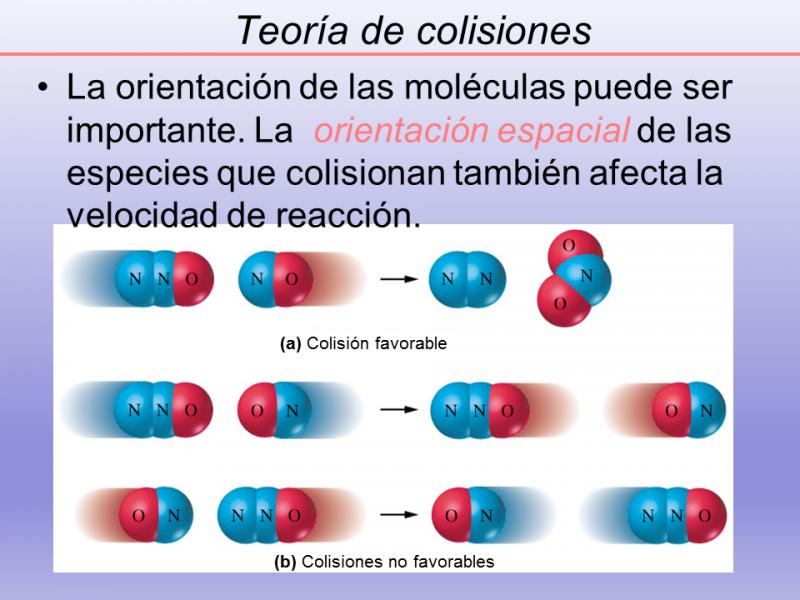
- Orientación correcta: además de tener la energía suficiente, las moléculas deben colisionar en la orientación adecuada para que los átomos involucrados puedan interactuar y formar nouveaux enlaces químicos. Si la colisión ocurre en una orientación incorrecta, las moléculas simplemente rebotarán sin reaccionar.
- Frecuencia de colisión: cuantas más colisiones ocurran entre las moléculas, mayor será la probabilidad de que se produzca una reacción química. La frecuencia de colisión depende de varios factores, como la concentración de los reactivos y la temperatura. A mayor concentración o temperatura, mayor será la frecuencia de colisión.
La Teoría de las Colisiones ha sido fundamental para entender y estudiar una amplia variedad de reacciones químicas. Por ejemplo, ha permitido explicar cómo funcionan las enzimas, catalizadores biológicos que aceleran las reacciones químicas en los organismos vivos. También ha contribuido al desarrollo de nuevos materiales y medicamentos, al proporcionar una base teórica para el diseño de reacciones químicas eficientes y selectivas.
La Teoría de las Colisiones es una herramienta invaluable en química que nos ayuda a comprender cómo ocurren las reacciones químicas a nivel molecular. Mediante el estudio de las colisiones entre moléculas, podemos predecir y controlar la velocidad y el resultado de las reacciones químicas, lo que tiene importantes implicaciones en el mundo de la ciencia y la tecnología.
Qué papel juegan las colisiones en las reacciones químicas
La Teoría de las Colisiones es fundamental para comprender el funcionamiento de las reacciones químicas en el ámbito de la química moderna. Esta teoría nos brinda una explicación detallada acerca de cómo ocurren las reacciones químicas y qué factores pueden influir en su velocidad.
Según esta teoría, para que ocurra una reacción química, es necesaria la colisión efectiva entre las moléculas de los reactivos. Esto significa que las moléculas deben chocar entre sí de manera correcta y con suficiente energía para romper los enlaces existentes y formar nuevos enlaces.
La colisión efectiva se produce cuando las moléculas chocan con una orientación adecuada y con energía cinética suficiente para superar la barrera de energía de activación. La energía cinética está relacionada con la temperatura del sistema, por lo que a mayor temperatura, mayor será la energía cinética promedio de las moléculas y, por lo tanto, mayor será la probabilidad de colisiones efectivas.
Influencia de la concentración de los reactivos
La concentración de los reactivos también juega un papel crucial en la velocidad de una reacción química. Según la Teoría de las Colisiones, a mayor concentración de los reactivos, mayor será la frecuencia de colisiones entre las moléculas, lo que aumenta la probabilidad de colisiones efectivas y, por ende, la velocidad de la reacción.
Por otro lado, si la concentración de los reactivos es baja, la frecuencia de colisiones entre las moléculas será menor y, por lo tanto, la probabilidad de colisiones efectivas también disminuirá. Esto resultará en una velocidad de reacción más lenta.
La importancia del estado físico de los reactivos
Además de la concentración, el estado físico de los reactivos también puede afectar la velocidad de una reacción química. En general, las reacciones son más rápidas cuando los reactivos se encuentran en estado gaseoso o en solución acuosa, ya que en estos estados las moléculas están más dispersas y tienen mayor libertad de movimiento, lo que facilita las colisiones entre ellas.
En contraste, las reacciones que involucran reactivos en estado sólido suelen ser más lentas, ya que las moléculas están más cercanas entre sí y tienen una menor movilidad. Esto dificulta las colisiones efectivas y, por lo tanto, reduce la velocidad de la reacción.
Influencia de la temperatura
Como se mencionó anteriormente, la temperatura es un factor determinante en la energía cinética de las moléculas y, por lo tanto, en la velocidad de una reacción química. A medida que aumenta la temperatura, las moléculas ganan energía cinética, lo que aumenta la probabilidad de colisiones efectivas.
Esto se debe a que a mayor temperatura, las moléculas se mueven más rápidamente y con mayor agitación, lo que favorece las colisiones y aumenta la energía con la que chocan. Por lo tanto, se incrementa la probabilidad de que las moléculas superen la barrera de energía de activación y ocurra la reacción química.
Otros factores que pueden afectar las colisiones
Además de los aspectos mencionados anteriormente, existen otros factores que pueden influir en las colisiones químicas. Algunos de ellos son:
Tamaño y forma de las moléculas:En general, las moléculas más pequeñas y compactas tienden a tener una mayor frecuencia de colisiones efectivas debido a su menor tamaño y mayor accesibilidad para interactuar entre sí.Presencia de catalizadores:Los catalizadores son sustancias que aumentan la velocidad de una reacción química al proporcionar un camino alternativo de menor energía de activación. Actúan disminuyendo las colisiones no efectivas y facilitando la formación de productos mediante colisiones efectivas.Presión:En el caso de reacciones gaseosas, la presión puede afectar las colisiones. A mayor presión, la cantidad de moléculas por unidad de volumen aumenta, lo que incrementa la probabilidad de colisiones efectivas.
La Teoría de las Colisiones es esencial para comprender cómo ocurren las reacciones químicas y qué factores pueden influir en su velocidad. El estudio de esta teoría nos permite comprender mejor la química moderna y su aplicación en distintos campos, como la síntesis de productos químicos, el diseño de nuevos medicamentos y la producción de materiales avanzados.
Cómo afectan la velocidad y la energía de las colisiones a las reacciones químicas
La Teoría de las Colisiones, también conocida como la "Teoría del Choque", es una teoría fundamental en la química moderna que explica cómo ocurren las reacciones químicas a nivel molecular. Esta teoría postula que para que se produzca una reacción química, las moléculas deben colisionar entre sí en la orientación correcta y con suficiente energía cinética.
En términos más sencillos, la velocidad y la energía de las colisiones entre las moléculas son factores clave en la determinación de la rapidez y la eficacia de una reacción química. La velocidad se refiere a la rapidez con la que las moléculas se mueven y chocan entre sí, mientras que la energía se refiere a la cantidad de energía necesaria para romper los enlaces químicos y formar nuevos enlaces.
Si la velocidad de las colisiones es baja, las moléculas tendrán menos oportunidades de colisionar entre sí y, por lo tanto, la reacción química será más lenta. Por otro lado, si la velocidad de las colisiones es alta, las moléculas tendrán más posibilidades de colisionar y, por lo tanto, la reacción química será más rápida. Así, podemos decir que la velocidad de las colisiones está directamente relacionada con la rapidez de la reacción química.
La importancia de la energía cinética en las colisiones
Junto a la velocidad de las colisiones, la energía de dichas colisiones es igualmente crucial en una reacción química. Para que ocurra una reacción, las moléculas deben tener suficiente energía cinética para superar la barrera de energía de activación, que es la cantidad mínima de energía necesaria para iniciar una reacción.
La energía cinética en las colisiones puede provenir de diferentes fuentes, como el calor, la luz u otras reacciones químicas. Cuando las moléculas colisionan con suficiente energía cinética, tienen la capacidad de romper enlaces y reorganizarse para formar nuevas sustancias.
Es importante destacar que no todas las colisiones entre moléculas conducen a una reacción química exitosa. Algunas colisiones pueden ser ineficaces si las moléculas no tienen la orientación correcta o si no tienen la energía cinética suficiente. Por lo tanto, la teoría de las colisiones también implica la importancia de la geometría molecular y la energía de activación en la determinación de la eficacia de una reacción química.
El impacto de la teoría de las colisiones en la química moderna
La Teoría de las Colisiones ha tenido un impacto significativo en la comprensión y aplicación de la química en diversos campos científicos y tecnológicos. Su desarrollo ha permitido a los químicos predecir y controlar la velocidad de las reacciones químicas, lo que a su vez ha llevado al diseño y desarrollo de nuevos materiales, medicamentos y procesos industriales.
Además, esta teoría ha ayudado a explicar fenómenos químicos complejos, como la velocidad de las reacciones en función de la temperatura y la concentración de los reactivos, así como la relación entre la energía cinética y la eficacia de las reacciones químicas.
La Teoría de las Colisiones es una herramienta fundamental en la química moderna que nos ayuda a comprender cómo ocurren las reacciones químicas a nivel molecular. La velocidad de las colisiones y la energía cinética de las moléculas son factores cruciales en la determinación de la rapidez y la eficacia de una reacción química. Gracias a esta teoría, los químicos han podido avanzar en la investigación y desarrollo de nuevos materiales y tecnologías que tienen un impacto significativo en nuestra sociedad.
Cuál es el concepto de energía de activación en la Teoría de las Colisiones? ¿Por qué es importante
La Teoría de las Colisiones es una parte fundamental de la química moderna. Para entender plenamente esta teoría, es crucial comprender el concepto de energía de activación y su importancia en los procesos químicos.
La energía de activación se refiere a la cantidad mínima de energía necesaria para que ocurra una reacción química. En otras palabras, es la barrera que debe superarse para que los reactivos se conviertan en productos. Sin suficiente energía de activación, la reacción no puede tener lugar.
En el contexto de la Teoría de las Colisiones, las moléculas deben colisionar entre sí con suficiente energía y de manera efectiva para que una reacción química ocurra. Si las moléculas no tienen la energía adecuada o si la colisión es ineficiente, la reacción no ocurrirá, incluso si los reactivos están presentes en abundancia.
¿Por qué es importante entender la energía de activación?
La comprensión de la energía de activación es fundamental para numerosos aspectos de la química. Aquí hay algunas razones por las que es importante:
- Cinemática de las reacciones químicas: La energía de activación determina la velocidad a la que ocurre una reacción química. Una energía de activación alta indica que una reacción será más lenta en comparación con una energía de activacion baja.
- Optimización de procesos químicos: Conocer la energía de activación es crucial para optimizar procesos químicos en la industria. Al comprender los requerimientos de energía necesarios para que ocurra una reacción, los científicos pueden encontrar formas de acelerarla o reducir su costo de producción.
- Selección de catalizadores: Los catalizadores son sustancias que aumentan la velocidad de las reacciones químicas al reducir la energía de activación necesaria. Comprender la energía de activación es esencial para seleccionar el catalizador adecuado y mejorar la eficiencia de las reacciones.
- Predicción y control de reacciones químicas: La energía de activación también ayuda a predecir y controlar el resultado de una reacción química. Al saber qué tan alta o baja es la barrera energética, los científicos pueden realizar ajustes para favorecer ciertos productos o evitar ciertas reacciones no deseadas.
La energía de activación es un concepto fundamental en la Teoría de las Colisiones y en la química en general. Su comprensión permite entender cómo ocurren las reacciones químicas y cómo se pueden optimizar para diversos fines aplicativos. Sin duda, este concepto juega un papel crucial en el avance de la química moderna y en la mejora de procesos industriales.
Cómo influyen la concentración y la temperatura en las colisiones químicas
La Teoría de las Colisiones es un concepto fundamental en la química moderna que se centra en el estudio de las reacciones químicas y cómo se llevan a cabo a nivel molecular. Esta teoría sostiene que para que una reacción química ocurra, las moléculas deben colisionar entre sí de manera efectiva.
Existen dos factores clave que influyen en las colisiones químicas: la concentración de las sustancias reactantes y la temperatura. Ambos tienen un impacto significativo en la rapidez y eficacia de las reacciones químicas.
Influencia de la concentración
La concentración de los reactantes juega un papel crucial en las colisiones químicas. A medida que aumenta la concentración de las sustancias reactantes, aumenta también el número de partículas presentes en un volumen determinado. Esto conlleva a un incremento en la frecuencia de colisiones entre las moléculas, lo que a su vez favorece la probabilidad de que ocurran reacciones químicas.
Si la concentración de las sustancias reactantes disminuye, la cantidad de partículas presentes en el sistema será menor. Como resultado, la frecuencia de colisiones disminuirá, lo que reducirá la probabilidad de que ocurran reacciones químicas.
Es importante destacar que esta relación no es lineal. Aunque el aumento de la concentración incrementa la frecuencia de colisiones, llega un punto en el que la concentración no tiene un efecto significativo en la velocidad de reacción. Esto se debe a que se alcanza una saturación en la cantidad de partículas reactantes presentes.
Influencia de la temperatura
La temperatura es otro factor crucial que afecta la velocidad de las colisiones químicas. A medida que la temperatura aumenta, las moléculas adquieren mayor energía cinética y se mueven con mayor rapidez. Esta mayor velocidad molecular resulta en un incremento en la frecuencia de colisiones entre las sustancias reactantes.
Además del aumento en la frecuencia de colisiones, el incremento de temperatura también aumenta la energía promedio de las colisiones. Las colisiones con mayor energía son más propensas a ser efectivas y permitir la formación de productos químicos.
Es importante destacar que existe un límite de temperatura a partir del cual el aumento de energía cinética puede tener efectos adversos. A temperaturas extremadamente altas, las moléculas pueden descomponerse o reaccionar de manera no deseada, lo que puede dificultar la obtención de productos químicos deseados.
La concentración de las sustancias reactantes y la temperatura son factores clave que influyen en las colisiones químicas. El aumento de la concentración favorece el aumento de la frecuencia de colisiones, mientras que el incremento de la temperatura aumenta tanto la frecuencia como la energía de las colisiones. Sin embargo, es importante encontrar un equilibrio, ya que valores extremos de concentración y temperatura pueden tener efectos indeseables en las reacciones químicas.
Qué tipo de colisiones son más eficientes para producir una reacción química
La teoría de las colisiones es un concepto fundamental en la química moderna que nos permite comprender cómo ocurren las reacciones químicas a nivel molecular. Nos ayuda a entender qué condiciones son necesarias para que una reacción tenga lugar y qué factores influyen en su velocidad.
Cuando dos moléculas se encuentran, es necesario que colisionen entre sí para que puedan interactuar y formar nuevos productos. Sin embargo, no todas las colisiones son igualmente eficientes a la hora de producir una reacción química. Algunas colisiones tienen la energía y orientación adecuadas para romper los enlaces existentes y formar enlaces nuevos, mientras que otras colisiones pueden ser ineficientes y no llevar a cabo ninguna transformación química.
Factor de energía cinética
Uno de los factores más importantes que determina si una colisión será eficiente es la energía cinética de las moléculas que colisionan. Para que ocurra una reacción química, las moléculas deben tener suficiente energía para superar la barrera de energía de activación requerida para romper los enlaces químicos y comenzar la formación de nuevos enlaces. Si la energía cinética de las moléculas es insuficiente, la colisión será ineficiente y no se producirá reacción química.
La energía cinética de las moléculas depende de su temperatura. A mayor temperatura, las moléculas poseen mayor energía cinética y, por lo tanto, tienen una mayor probabilidad de colisionar con la energía suficiente para iniciar una reacción química. Esto explica por qué muchas reacciones son más rápidas a temperaturas más altas.
Factor de orientación
Además de la energía cinética, la orientación de las moléculas también juega un papel crucial en la eficiencia de una colisión. Para que ocurra una reacción química, las moléculas deben colisionar de manera adecuada, es decir, con una orientación favorable que permita la ruptura y formación de enlaces químicos.
La orientación correcta depende de la geometría y la posición relativa de las moléculas. Si las moléculas no tienen la orientación adecuada al colisionar, es menos probable que se forme una estructura intermedia reactiva y se produzca una reacción química. Esto explica por qué ciertos compuestos pueden tener una reactividad diferente a pesar de tener la misma energía cinética.
Efecto de la concentración y el catalizador
Además de los factores mencionados anteriormente, la concentración de las sustancias reactantes y la presencia de un catalizador también pueden influir en la eficiencia de las colisiones y, por lo tanto, en la velocidad de la reacción química.
A mayor concentración de las sustancias reactantes, mayor será la probabilidad de que las moléculas colisionen entre sí. Esto aumenta la frecuencia de las colisiones y, por lo tanto, la velocidad de la reacción química. Por otro lado, un catalizador puede aumentar la velocidad de la reacción química al proporcionar una ruta de reacción alternativa con una menor barrera de energía de activación.
No todas las colisiones entre moléculas son igualmente eficientes para producir una reacción química. La energía cinética, la orientación, la concentración de las sustancias reactantes y la presencia de un catalizador son factores que determinan la eficiencia de una colisión. Comprender estos factores nos permite controlar y optimizar las reacciones químicas en diversos campos como la síntesis de compuestos farmacéuticos, la producción de materiales y la investigación científica.
Cuáles son algunos ejemplos prácticos de la Teoría de las Colisiones en la vida cotidiana
La Teoría de las Colisiones es un concepto clave en la química moderna que busca explicar cómo se producen las reacciones químicas a nivel molecular. Esta teoría se basa en la idea de que las reacciones químicas solo pueden ocurrir cuando las moléculas colisionan entre sí con la energía adecuada y en la orientación correcta.
Aunque pueda parecer una teoría abstracta, su aplicación se encuentra presente en múltiples aspectos de nuestra vida cotidiana. A continuación, exploraremos algunos ejemplos prácticos de la Teoría de las Colisiones:
1. Combustión de gasolina en los motores de automóviles
Uno de los ejemplos más comunes de la Teoría de las Colisiones es el proceso de combustión de la gasolina en los motores de automóviles. Para que la gasolina se queme y genere la energía necesaria para hacer funcionar el motor, se requiere que las moléculas de gasolina colisionen entre sí y con el oxígeno presente en el aire con suficiente energía y en la posición adecuada. Si no se cumplen estas condiciones, la reacción de combustión no ocurrirá correctamente y el motor no funcionará de manera eficiente.
2. Cocción de alimentos
Otro ejemplo práctico de la Teoría de las Colisiones es el proceso de cocción de alimentos. Cuando colocamos un alimento en una sartén caliente, las moléculas de los ingredientes presentes en el alimento deben colisionar entre sí para que ocurra la cocción. Esta colisión genera la energía necesaria para que se produzcan las reacciones químicas que transforman los ingredientes y los hacen aptos para el consumo.
3. Reacciones químicas en la industria farmacéutica
La Teoría de las Colisiones también juega un papel fundamental en el desarrollo y producción de medicamentos en la industria farmacéutica. Para que una reacción química tenga lugar y se forme el compuesto deseado, es necesario controlar las condiciones de temperatura, presión y concentración de las sustancias que reaccionan. Estas condiciones óptimas permiten que las moléculas colisionen entre sí de manera eficiente y generen la reacción química deseada.
4. Fermentación en la elaboración de productos alimenticios
En la elaboración de productos alimenticios como el pan o la cerveza, la Teoría de las Colisiones también desempeña un papel crucial. Durante el proceso de fermentación, las levaduras presentes en la masa o en el mosto deben colisionar con los azúcares presentes para convertirlos en dióxido de carbono y alcohol. Estas colisiones son fundamentales para la obtención del producto final con las características deseadas.
Estos ejemplos ilustran cómo la Teoría de las Colisiones está presente en nuestra vida cotidiana de formas más relevantes de lo que podríamos imaginar. Desde la combustión de gasolina en vehículos hasta la fermentación en la producción de alimentos y bebidas, esta teoría nos ayuda a comprender y controlar las reacciones químicas que tienen lugar a nuestro alrededor.
Qué aplicaciones tiene la Teoría de las Colisiones en diferentes campos de la química
La Teoría de las Colisiones es fundamental en el estudio de la química moderna, ya que proporciona una base sólida para comprender las reacciones químicas y sus aplicaciones en numerosos campos. A continuación, exploraremos algunas de las principales áreas en las que se aplica esta teoría.
1. Cinética Química
Una de las aplicaciones más importantes de la Teoría de las Colisiones es en la cinética química, que se encarga del estudio de la velocidad de las reacciones químicas. La teoría nos permite entender cómo ocurren las colisiones entre las moléculas reactantes y cómo estas colisiones influyen en la velocidad de la reacción. A partir de la teoría, podemos determinar qué factores afectan la frecuencia de las colisiones, como la concentración de los reactivos, la temperatura y la presión, entre otros.
2. Catálisis
La catálisis es un proceso en el cual una sustancia llamada catalizador acelera una reacción química sin ser consumida en ella. La Teoría de las Colisiones es esencial para entender cómo funciona la catálisis. Según la teoría, el catalizador proporciona una ruta alternativa con una menor energía de activación para la reacción, lo cual permite que las colisiones entre las moléculas reactantes ocurran con mayor frecuencia y, por lo tanto, aumente la velocidad de la reacción.
3. Estudio de Mecanismos de Reacción
Los mecanismos de reacción son una descripción detallada de los pasos por los cuales ocurre una reacción química. La Teoría de las Colisiones se utiliza para investigar y comprender los diferentes estados de transición y etapas intermedias involucradas en un mecanismo de reacción. A través de la teoría, podemos determinar qué moléculas colisionan entre sí, cómo varían las velocidades de las diferentes etapas y qué factores pueden afectar dichas velocidades.
4. Diseño de Reactores Químicos
El diseño de reactores químicos es un proceso crucial en la industria química, ya que permite optimizar la producción de sustancias químicas y mejorar su eficiencia. La Teoría de las Colisiones es utilizada en el diseño de estos reactores para predecir cómo se comportarán las moléculas reactantes y cómo se pueden maximizar las colisiones efectivas para obtener la máxima conversión de reactivos en productos.
5. Cinética de Reacciones en Solución
La mayoría de las reacciones químicas ocurren en solución, y la Teoría de las Colisiones es utilizada para estudiar la cinética de estas reacciones en medios acuosos u otros disolventes. La teoría nos ayuda a entender cómo interactúan las moléculas soluto y solvente, cómo influyen las interacciones entre las especies químicas en la velocidad de reacción y cómo se pueden modificar estas velocidades a través de la temperatura o el pH, por ejemplo.
La Teoría de las Colisiones es una herramienta invaluable en el estudio de la química y sus aplicaciones en diversos campos. Permite entender la cinética de las reacciones, facilita el diseño de reactores químicos eficientes, ayuda a elucidar mecanismos de reacción y contribuye al desarrollo de nuevas tecnologías y productos químicos.
Cuáles son los principales avances en la comprensión de las colisiones químicas gracias a la Teoría de las Colisiones
La Teoría de las Colisiones es una herramienta fundamental en la química moderna que nos permite comprender y estudiar cómo ocurren las reacciones químicas. Específicamente, se enfoca en el estudio de las colisiones entre moléculas y átomos, y cómo estas colisiones influyen en la velocidad y el resultado de una reacción química.
Desde su formulación por parte de Max Trautz y William Lewis a principios del siglo , la Teoría de las Colisiones ha experimentado importantes avances que han ampliado nuestro conocimiento sobre este fenómeno fundamental. A continuación, presentamos algunos de los principales logros en la comprensión de las colisiones químicas gracias a esta teoría.
1. Determinación de la energía de activación
Uno de los aspectos más destacados de la Teoría de las Colisiones es su capacidad para determinar la energía de activación de una reacción química. La energía de activación es la cantidad mínima de energía que debe tener una colisión para que una reacción ocurra. La teoría nos proporciona un marco conceptual para entender cómo varía la energía de activación en función de diferentes factores, como la temperatura, la concentración de reactantes y la naturaleza de las moléculas o átomos implicados. Esto ha sido crucial en el diseño y desarrollo de nuevos catalizadores y procesos químicos más eficientes.
2. Estudio de la constante de velocidad
Otro avance importante ha sido la capacidad de la Teoría de las Colisiones para estudiar la constante de velocidad de una reacción química. La constante de velocidad es una medida cuantitativa de qué tan rápido o lento ocurre una reacción, y saber cómo varía en función de diferentes condiciones nos permite comprender mejor los mecanismos subyacentes de la reacción. Mediante la aplicación de la teoría, se han desarrollado modelos matemáticos que relacionan la constante de velocidad con factores como la geometría molecular, la energía de activación y la presencia de catalizadores.
3. Predicción de productos de reacción
La Teoría de las Colisiones también ha contribuido significativamente a la capacidad de predecir los productos de una reacción química. Al estudiar las características de las colisiones entre moléculas y átomos antes de una reacción, es posible inferir qué compuestos se formarán como resultado. Esto es especialmente útil en el diseño de síntesis químicas y la optimización de procesos industriales, ya que permite prever y controlar selectivamente los productos deseados.
La Teoría de las Colisiones ha sido clave en la comprensión y avance de la química moderna. Gracias a sus principios fundamentales, hemos podido determinar la energía de activación, estudiar la constante de velocidad y predecir los productos de las reacciones químicas. Estos avances nos permiten manipular y controlar las transformaciones químicas de manera más eficiente y precisa, abriendo nuevas puertas hacia el desarrollo de materiales y procesos químicos más sostenibles y funcionales.
Preguntas frecuentes (FAQ)
1. ¿Qué es la Teoría de las Colisiones?
La Teoría de las Colisiones es un modelo que explica cómo se producen las reacciones químicas a nivel molecular, centrándose en la colisión entre partículas.
2. ¿Cuál es el objetivo de la Teoría de las Colisiones?
El objetivo principal de la Teoría de las Colisiones es predecir y entender la velocidad y la eficacia de las reacciones químicas.
3. ¿Cuáles son los factores que afectan a las colisiones químicas?
Los factores principales que afectan a las colisiones químicas son: la velocidad relativa de las partículas, la energía cinética de las partículas y la orientación favorable de las colisiones.
4. ¿Qué sucede cuando ocurre una colisión efectiva?
Cuando ocurre una colisión efectiva, las moléculas interactúan lo suficiente como para formar nuevos productos químicos.
5. ¿Cómo se relaciona la Teoría de las Colisiones con la velocidad de reacción?
La Teoría de las Colisiones establece que cuanto mayor sea la frecuencia de las colisiones efectivas y la energía cinética de las partículas, más rápida será la velocidad de reacción.

Entradas relacionadas